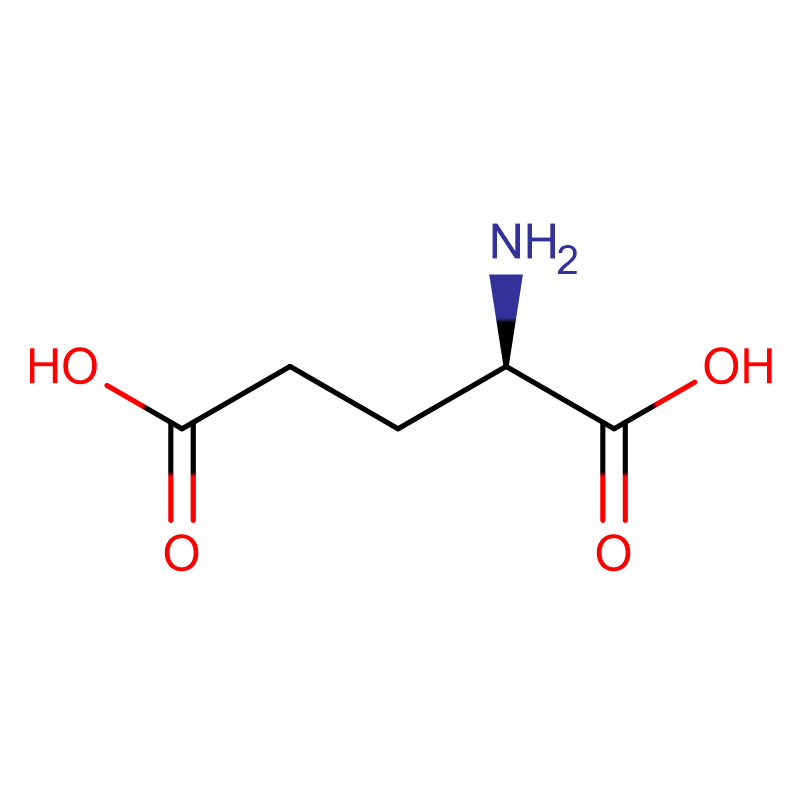
D-Glutaminsyra CAS:6893-26-1 99% Vitt pulver
| Katalognummer | XD90313 |
| produktnamn | D-glutaminsyra |
| CAS | 6893-26-1 |
| Molekylär formel | C5H9NO4 |
| Molekylvikt | 147,13 |
| Förvaringsdetaljer | Omgivande |
| Harmoniserad tullkodex | 29224200 |
Produktspecifikation
| Utseende | Vitt kristallint pulver |
| Analysera | 99 % |
| Specifik rotation | -31 till -32,2 |
| Tungmetaller | <10 ppm |
| AS | <1 ppm |
| pH | 3 - 3,5 |
| SO4 | <0,020 % |
| Fe | <10 ppm |
| Förlust vid torkning | <0,20 % |
| Rester vid antändning | <0,10 % |
| NH4 | <0,02 % |
| Cl | <0,02 % |
| Tillstånd för lösning | >98 % |
γ-Glutamyltranspeptidaser (γ-GTs) klyver γ-glutamylamidbindningen av glutation och överför den frigjorda γ-glutamylgruppen till vatten (hydrolys) eller acceptoraminosyror (transpeptidering).Dessa allestädes närvarande enzymer spelar en nyckelroll i biosyntesen och nedbrytningen av glutation, och i xenobiotisk avgiftning.Här rapporterar vi 3Å-upplösningskristallstrukturen för Bacillus licheniformis γ-GT (BlGT) och den för dess komplex med l-Glu.Röntgenstrukturer bekräftar att BlGT tillhör den N-terminala nukleofila hydrolas-superfamiljen och avslöjar att proteinet har en öppnad klyvning av aktivt ställe som liknar den som rapporterats för det homologa enzymet från Bacillus subtilis, men skiljer sig från de som observerats för humant γ-GT och för γ-GT från andra mikroorganismer.Data tyder på att bindningen av l-Glu inducerar en omordning av den C-terminala svansen av BlGTs stora subenhet och tillåter identifiering av ett kluster av syrarester som potentiellt är involverade i igenkännandet av en metalljon.Dessa resters roll på konformationsstabiliteten hos BlGT har studerats genom att karakterisera autobearbetningen, enzymaktiviteten, kemisk och termisk denaturering av fyra nya Ala enstaka mutanter.Resultaten visar att ersättning av Asp568 med en Ala påverkar både autobearbetningen och den strukturella stabiliteten hos proteinet.