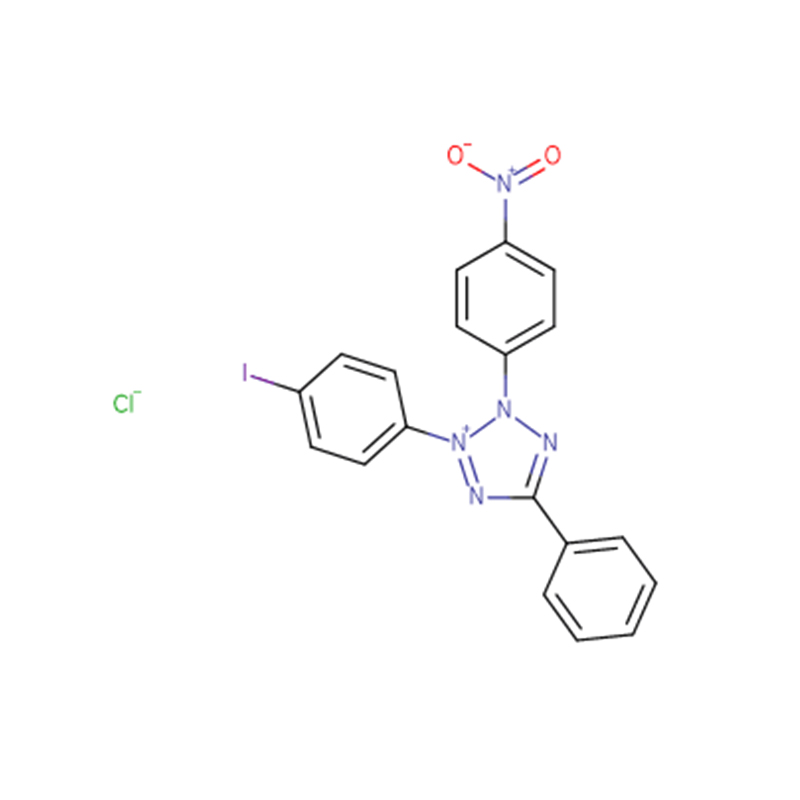
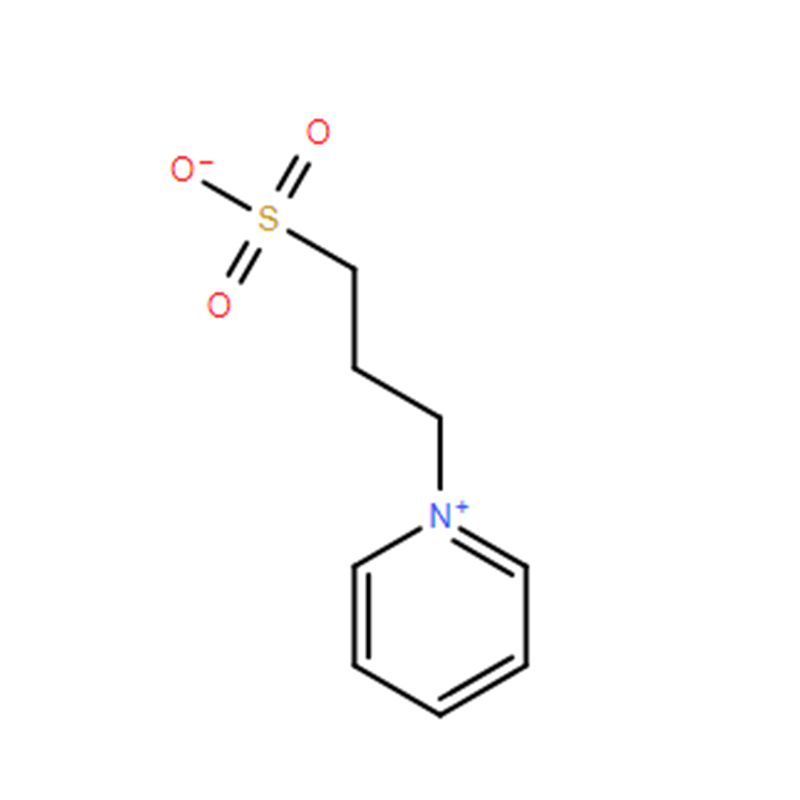
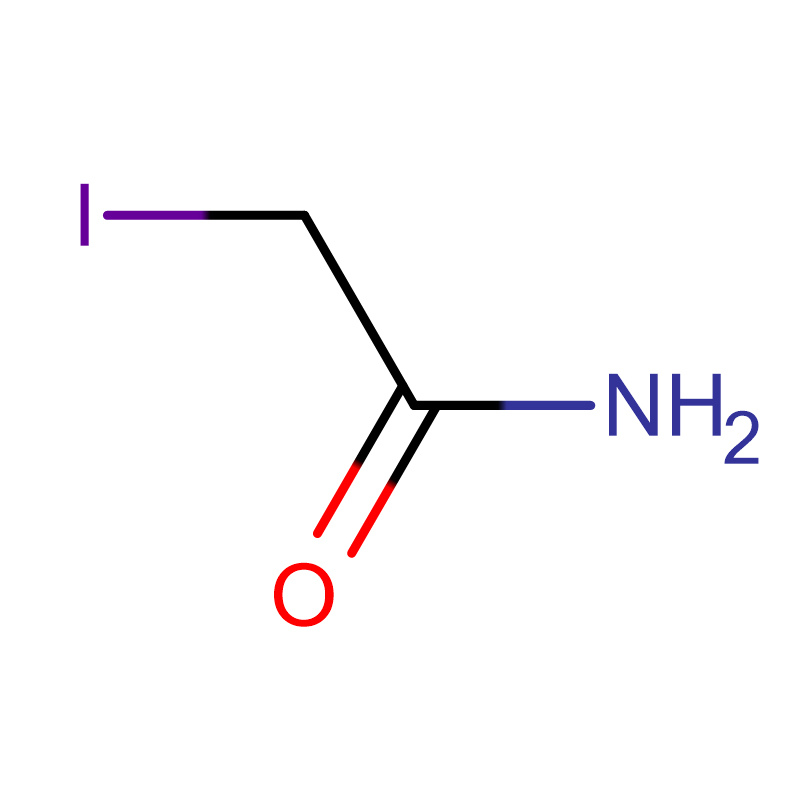
Jodonitrotetrazoliumklorid Cas: 146-68-9 98% Ljusgult till orange pulver
| Katalognummer | XD90217 |
| produktnamn | Jodonitrotetrazoliumklorid |
| CAS | 146-68-9 |
| Molekylär formel | C19H13ClIN5O2 |
| Molekylvikt | 505,70 |
| Förvaringsdetaljer | 2 till 8 °C |
| Harmoniserad tullkodex | 32129000 |
Produktspecifikation
| Identifiering | H-NMR |
| Löslighet | Klar lösning |
| Utseende | Ljusgult till orange pulver |
| Analys HPLC | >98 % |
En reciprok translokation av ABL1-genen till BCR-genen resulterar i uttrycket av det onkogena BCR-ABL1-fusionsproteinet, som kännetecknar human kronisk myeloid leukemi (CML), en myeloproliferativ störning som alltid anses vara dödlig fram till introduktionen av imatinibfamiljen av tyrosinkinas. inhibitorer (TKI).Icke desto mindre är okänslighet hos KML-stamceller för TKI-behandling och inneboende eller förvärvad resistens fortfarande vanliga orsaker till sjukdomspersistens och blastisk fasprogression hos patienter efter initiala framgångsrika terapier.Här undersökte vi en möjlig roll för MAPK15/ERK8-kinaset i BCR-ABL1-beroende autofagi, en nyckelprocess för onkogeninducerad leukemogenes.I detta sammanhang visade vi förmågan hos MAPK15 att fysiskt rekrytera onkogenen till autofagiska vesiklar, vilket bekräftar vår hypotes om en biologiskt relevant roll för detta MAP-kinas i signaltransduktion av denna onkogen.Genom att modellera BCR-ABL1-signalering i HeLa-celler och dra fördel av en fysiologiskt relevant modell för human CML, dvs K562-celler, visade vi faktiskt att BCR-ABL1-inducerad autofagi medieras av MAPK15 genom dess förmåga att interagera med LC3-familjen proteiner, på ett LIR-beroende sätt.Intressant nog kunde vi också störa BCR-ABL1-inducerad autofagi genom ett farmakologiskt tillvägagångssätt som syftar till att hämma MAPK15, vilket öppnar möjligheten att agera på detta kinas för att påverka autofagi och sjukdomar beroende på denna cellulära funktion.För att stödja genomförbarheten av detta tillvägagångssätt visade vi faktiskt att utarmning av endogent MAPK15-uttryck hämmade BCR-ABL1-beroende cellproliferation, in vitro och tumörbildning, in vivo, vilket ger en ny "läkemedelsbar" länk mellan BCR-ABL1 och human CML.