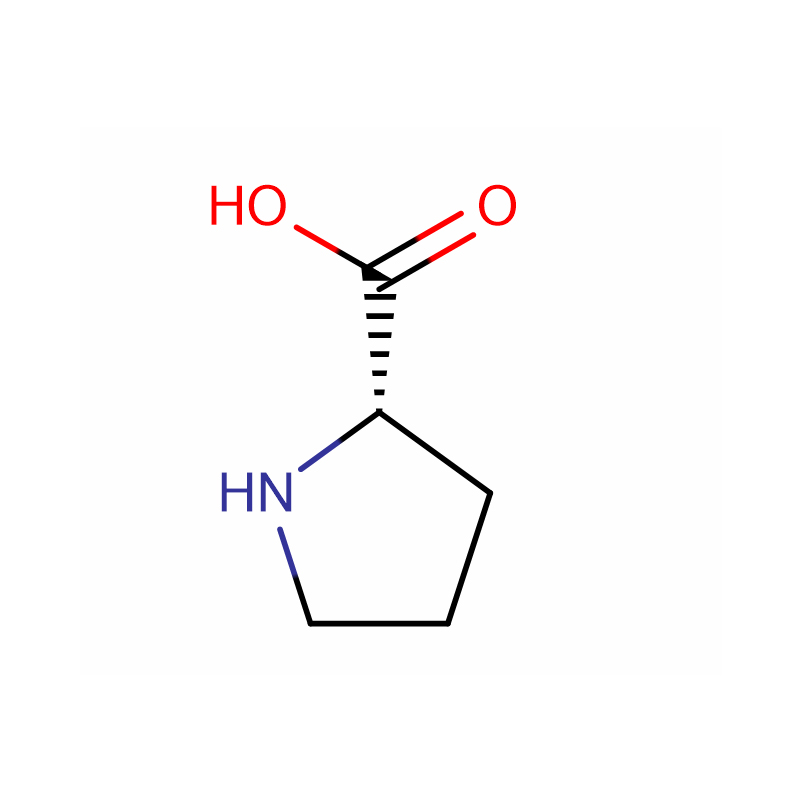
L-Proline Cas: 147-85-3 99% Vitt pulver
| Katalognummer | XD90293 |
| produktnamn | L-prolin |
| CAS | 147-85-3 |
| Molekylär formel | C5H9NO2 |
| Molekylvikt | 115.13046 |
| Förvaringsdetaljer | Omgivande |
| Harmoniserad tullkodex | 29339980 |
Produktspecifikation
| Analysera | 99 % min |
| Utseende | vitt pulver |
| Specifik rotation | -84,5 till -86 |
| Tungmetaller | <15 ppm |
| AS | <1 ppm |
| Ph | 5,9 - 6,9 |
| SO4 | <0,050 % |
| Fe | <30 ppm |
| Förlust vid torkning | <0,3 % |
| Rester vid antändning | <0,10 % |
| NH4 | <0,02 % |
| Cl | <0,050 % |
| Tillstånd för lösning | >98 % |
Att förstå metabolismen hos den mikrobiella värden är avgörande för utveckling och optimering av helcellsbaserade biokatalytiska processer, eftersom det dikterar produktionseffektivitet.Detta gäller särskilt för redoxbiokatalys där metaboliskt aktiva celler används på grund av den kofaktor/samsubstrat-regenererande förmågan som är endogen i värden.Rekombinant Escherichia coli användes för att överproducera prolin-4-hydroxylas (P4H), ett dioxygenas som katalyserar hydroxyleringen av fritt L-prolin till trans-4-hydroxi-L-prolin med a-ketoglutarat (a-KG) som samsubstrat.I denna helcellsbiokatalysator tillhandahåller central kolmetabolism det nödvändiga samsubstratet a-KG, vilket kopplar P4H biokatalytisk prestanda direkt till kolmetabolism och metabolisk aktivitet.Genom att tillämpa både experimentella och beräkningsbiologiska verktyg, såsom metabolisk ingenjörskonst och (13)C-metabolisk flödesanalys ((13)C-MFA), undersökte och kvantitativt beskrev vi det fysiologiska, metabola och bioenergetiska svaret hos helcellsbiokatalysatorn till den riktade bioomvandlingen och identifierade möjliga metaboliska flaskhalsar för ytterligare rationell processteknik. En E. coli-stam som saknade prolinnedbrytning konstruerades genom att ta bort putA-genen som kodar för prolinedehydrogenas.Helcellsbiotransformationer med denna mutanta stam ledde inte bara till kvantitativ prolinhydroxylering utan också till en fördubbling av den specifika trans-4-L-hydroxiprolin (hyp) bildningshastigheten, jämfört med vildtypen.Analys av kolflöde genom central metabolism av mutantstammen avslöjade att det ökade a-KG-behovet för P4H-aktivitet inte ökade det a-KG-genererande flödet, vilket tyder på en hårt reglerad TCA-cykeloperation under de studerade förhållandena.I vildtypsstammen orsakade P4H-syntes och katalys en minskning av biomassautbytet.Intressant nog kompenserade ΔputA-stammen dessutom den associerade ATP- och NADH-förlusten genom att minska underhållsenergibehovet vid jämförbart låga glukosupptagshastigheter, istället för att öka TCA-aktiviteten. PutA-utslaget i rekombinant E. coli BL21(DE3)(pLysS) visade sig vara vara lovande för produktiv P4H-katalys inte bara när det gäller utbyte av biotransformation, utan också när det gäller hastigheterna för biotransformation och prolinupptag och utbytet av hyp på energikällan.Resultaten indikerar att, vid en putA-knockout, blir kopplingen av TCA-cykeln till prolinhydroxylering via samsubstratet a-KG en nyckelfaktor som begränsar och ett mål för att ytterligare förbättra effektiviteten av a-KG-beroende biotransformationer.