IPTG (isopropyl-β-D-tiogalaktosid) är en analog till β-galaktosidassubstrat, som är mycket inducerbart.Under induktion av IPTG kan induceraren bilda ett komplex med repressorproteinet, så att konformationen av repressorproteinet ändras, så att det inte kan kombineras med målgenen, och målgenen uttrycks effektivt.Så hur ska koncentrationen av IPTG bestämmas under experimentet?Är ju större desto bättre?
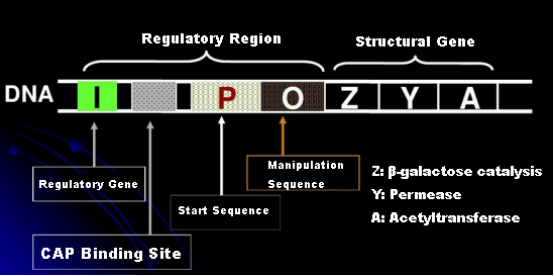
Låt oss först förstå principen för IPTG-induktion: E. colis laktosoperon (element) innehåller tre strukturella gener, Z, Y och A, som kodar för β-galaktosidas, permeas respektive acetyltransferas.lacZ hydrolyserar laktos till glukos och galaktos, eller till allolaktos;lacY tillåter laktos i miljön att passera genom cellmembranet och kommer in i cellen;lacA överför acetylgruppen från acetyl-CoA till β-galaktosid, vilket innebär att toxisk effekt tas bort.Dessutom finns en operationssekvens O, en startsekvens P och en regulatorisk gen I. I-genkoden är ett repressorprotein som kan binda till positionen O i operatorsekvensen, så att operonet (meta) undertrycks och avstängd.Det finns också ett bindningsställe för kataboliskt genaktivatorprotein-CAP-bindningsställe uppströms om den initierande sekvensen P. P-sekvensen, O-sekvensen och CAP-bindningsstället utgör tillsammans den regulatoriska regionen av lac-operonet.De kodande generna för de tre enzymerna regleras av samma regulatoriska region för att uppnå det koordinerade uttrycket av genprodukter.
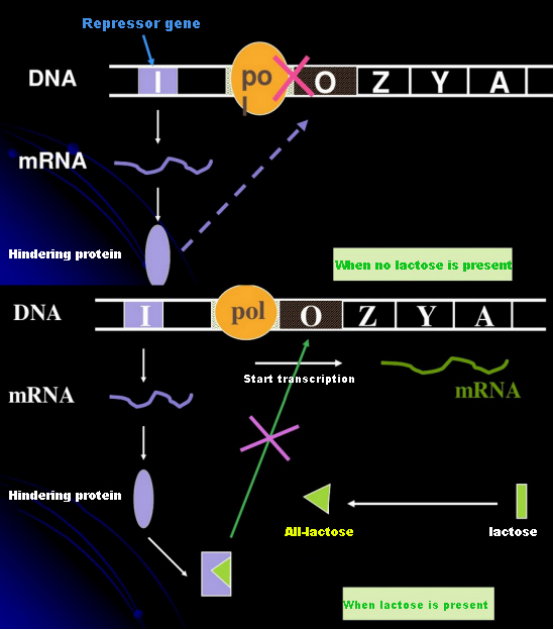
I frånvaro av laktos är lac-operonet (meta) i ett tillstånd av förtryck.Vid denna tidpunkt binder lac-repressorn uttryckt av I-sekvensen under kontroll av PI-promotorsekvensen till O-sekvensen, vilket förhindrar RNA-polymeras från att binda till P-sekvensen och hämmar transkriptionsinitiering;när laktos är närvarande kan lac-operonet (meta) induceras. I detta operonsystem (meta) är den verkliga induceraren inte laktosen själv.Laktos kommer in i cellen och katalyseras av β-galaktosidas för att omvandlas till allolaktos.Den senare, som en inducerande molekyl, binder till repressorproteinet och ändrar proteinkonformationen, vilket leder till dissociationen av repressorproteinet från O-sekvensen och transkription.Isopropyltiogalaktosid (IPTG) har samma effekt som allolaktos.Det är en mycket kraftfull inducerare, som inte metaboliseras av bakterier och är mycket stabil, så den används ofta i laboratorier.
Hur bestämmer man den optimala koncentrationen av IPTG?Ta E. coli som exempel.
Den genetiskt modifierade E. coli BL21-stammen innehållande den positiva rekombinanta pGEX (CGRP/msCT) inokulerades i LB flytande medium innehållande 50μg·mL-1 Amp och odlades över natten vid 37°C.Ovanstående kultur inokulerades i 10 flaskor med 50mL färskt LB flytande medium innehållande 50μg·mL-1 Amp i ett förhållande av 1:100 för expansionsodling, och när OD600-värdet var 0,6~0,8, tillsattes IPTG till slutkoncentrationen.Det är 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0 mmol·L-1.Efter induktion vid samma temperatur och samma tid togs 1 ml av bakterielösningen från den, och bakteriecellerna samlades upp genom centrifugering och utsattes för SDS-PAGE för att analysera inverkan av olika IPTG-koncentrationer på proteinuttryck, och sedan välj IPTG-koncentrationen med det största proteinuttrycket.
Efter experiment kommer det att visa sig att koncentrationen av IPTG inte är så stor som möjligt.Detta beror på att IPTG har en viss toxicitet för bakterier.Att överskrida koncentrationen kommer också att döda cellen;och generellt sett hoppas vi att ju mer lösligt protein som uttrycks i cellen, desto bättre, men i många fall när koncentrationen av IPTG är för hög kommer en stor mängd inneslutning att bildas.Kroppen, men mängden lösligt protein minskade.Därför är den mest lämpliga IPTG-koncentrationen ofta inte ju större desto bättre, utan ju lägre koncentration.
Syftet med induktion och odling av genetiskt modifierade stammar är att öka utbytet av målproteinet och minska kostnaderna.Expressionen av målgenen påverkas inte bara av stammens egna faktorer och expressionsplasmiden utan även av andra yttre förhållanden, såsom koncentrationen av induceraren, induktionstemperaturen och induktionstiden.Därför, i allmänhet, innan ett okänt protein uttrycks och renas, är det bäst att studera induktionstiden, temperaturen och IPTG-koncentrationen för att välja lämpliga förhållanden och få de bästa experimentella resultaten.
Posttid: 2021-12-31

